7.81 El número atómicode un elemento es 73. ¿Los átomos de este elemento son diamagnéticos o paramagnéticos?
Los átomos de dicho elemento son paramagnéticos ya que es un número impar.
martes, 10 de mayo de 2011
Configuración electrónica
7.77 Explica que significa el Kernell de gas noble. Escribe la configuración electrónica del Kernell de gas noble del xenón.
Kernell de gas noble es una forma de simplificación de la configuración electrónica de un elemento sustituyendo los electrones anterirores a la capa de valencia por la configuración del gas noble al que corresponden.
viernes, 6 de mayo de 2011
Configuracón electrónica
7.75 Definde los siguienetes términos y da un ejemplo de cada uno: metales de transición, actínidos y lantánidos.
Metales de transición:
Definición: Son aquellos elementos químicos que se encuentran en la parte central del sistema periódico, en el bloque d cuya principa característica es la inclusión en si configuración electrónica del orbital d, parcialmente lleno de elctrónes. Un elemento de transición son aquellos que poseen electrones alojados en el orbital d. En definición de la IUPAC dice que un metal de transición es "un elemento cuyo átomo tiene una subcapa d incompleta o que puede dar lugar a cationes con una subcapa d incompleta"
Ejemplo: Zinc (Zn)

Metales actínidos:
Definición: Los actínidos son un grupo de elementos que forman parte del periodo 7 de la tabla periódica. son llamados también elementos de transición interna. Estos elementos se suelen situar debajo del resto, dando una tabla más compacta que si se colocaran entre los elementos del bloque s y los del bloque d. Son los de mayor número atómico, no se encuentran en la naturaleza y tienen tiempos de vida media cortos; todos sus isótopos son radiactivos
Ejemplo: Actinio (Ac)

Metales Lantánidos
Definición: Ocupan en subnivel electrónico 4f. En un principio, sólo estos elementos con números atómicos 58 a 71 son lantánidos.
Ejemplo: Cerio (Ce)

Metales de transición:
Definición: Son aquellos elementos químicos que se encuentran en la parte central del sistema periódico, en el bloque d cuya principa característica es la inclusión en si configuración electrónica del orbital d, parcialmente lleno de elctrónes. Un elemento de transición son aquellos que poseen electrones alojados en el orbital d. En definición de la IUPAC dice que un metal de transición es "un elemento cuyo átomo tiene una subcapa d incompleta o que puede dar lugar a cationes con una subcapa d incompleta"
Ejemplo: Zinc (Zn)

Metales actínidos:
Definición: Los actínidos son un grupo de elementos que forman parte del periodo 7 de la tabla periódica. son llamados también elementos de transición interna. Estos elementos se suelen situar debajo del resto, dando una tabla más compacta que si se colocaran entre los elementos del bloque s y los del bloque d. Son los de mayor número atómico, no se encuentran en la naturaleza y tienen tiempos de vida media cortos; todos sus isótopos son radiactivos
Ejemplo: Actinio (Ac)

Metales Lantánidos
Definición: Ocupan en subnivel electrónico 4f. En un principio, sólo estos elementos con números atómicos 58 a 71 son lantánidos.
Ejemplo: Cerio (Ce)

Configuración electrónica
7.73 Explica el significado de los términos diamagnético y paramagnético. Da un ejemplo de un átomo que sea diamagnético y otro de uno que sea para magnético. ¿Qué significa la expresión "los electrones están apareados"?
DIAMAGNÉTICO: Son metales repelidos por el imán con fuerza imperceptible a simple vista. PARAMEGNETICO: Cuando se colocan metales paramagnéticos en las proximidades de un imán son atraídos con una fuerza muy pequeña, imperceptible a simple vista.
ejemplos:
DIAMAGNÉTICO: Son metales repelidos por el imán con fuerza imperceptible a simple vista. PARAMEGNETICO: Cuando se colocan metales paramagnéticos en las proximidades de un imán son atraídos con una fuerza muy pequeña, imperceptible a simple vista.
ejemplos:
- Diamagnético: Bi, Hg o C6H6
- Paramagnético:Al, O2, FeCl
Configuración electrónica
7.71 ¿Qué es la configuración electrónica? Describe la importancia del principio de exclusión de Pauli y de la regla de Hund en la escritura de la configuración electrónica de los elementos.
La configuración electrónica es la manera en la cual los electrones se estructuran en: un átomo, molécula o en otra estructura física; de acuerdo con el modelo de capas electrónico en el cual en el cual la función de onda del sistema se expresa como un producto de orbitales antisimetrizado. El pricipo de exclusión de Pauli establece que no puede fermiones (es uno de los dos tipos básicos de partículas que existen en la naturaleza) con todos sus números cuánticos idénticos.El principio de exclusión de Pauli sólo se aplica a fermiones, esto es, partículas que forman estados cuánticos antisimétricos y que tienen espín semientero. La regla de Hund es una regla empírica que dice que todos los orbitales deben estar llenos y todos los electrones en paralelo antes de que un orbital gane un segundo electrón. Y cuando un orbital gana un segundo electrón, éste deberá estar lleno del primero (espines opuestos o antiparalelos).
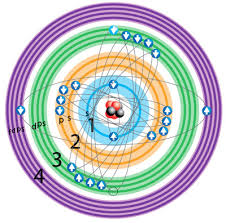
 <--- Pauli
<--- Pauli
La configuración electrónica es la manera en la cual los electrones se estructuran en: un átomo, molécula o en otra estructura física; de acuerdo con el modelo de capas electrónico en el cual en el cual la función de onda del sistema se expresa como un producto de orbitales antisimetrizado. El pricipo de exclusión de Pauli establece que no puede fermiones (es uno de los dos tipos básicos de partículas que existen en la naturaleza) con todos sus números cuánticos idénticos.El principio de exclusión de Pauli sólo se aplica a fermiones, esto es, partículas que forman estados cuánticos antisimétricos y que tienen espín semientero. La regla de Hund es una regla empírica que dice que todos los orbitales deben estar llenos y todos los electrones en paralelo antes de que un orbital gane un segundo electrón. Y cuando un orbital gana un segundo electrón, éste deberá estar lleno del primero (espines opuestos o antiparalelos).
 <--- Pauli
<--- Pauli
Orbitales Atómicos
7.69 Describe las formas de los orbitales s,p y d ¿Cómo se relacionan estos orbiatles con los números cúanticos n, l y ml ?
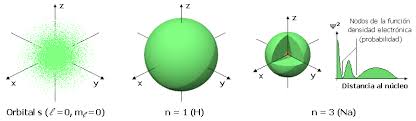
Orbital s
El orbital s tiene una simetría esférica alrededor del núcleo atómico. Existen dos formas para representar la nube electrónica de un orbital s.
1. La probabilidad de encontrar un electrón disminuye con la medida que nos alejamos del centro.
2. El volumen esférico en el que el electrón pasa la mayor parte del tiempo.

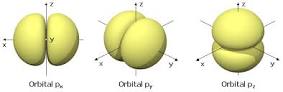
Orbital p
La forma de los orbitales p es la de dos esferasachatadas hacia el punto de contacto y orientadas según los ejes de coordenadas. En la función de valores que pueden tomar el 3 numero cúantico ml (-1, 0 y 1) obtiene los tres orbitales simétricos con respecto a los ejes x, z e y. El orbital p también representa la energía que posee un electrón y se incrementa con la medida en que se aleja entre la distancia del núcleo y el orbital.

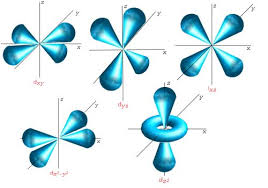
Orbital d .
Los orbitales d tienen una forma más diferente: 4 de ellos tienen forma de 4 lóbulos de signos alternados (dos planos nodales, en diferentes orientaciones del espacio), y el último es un doble lóbulo rodeado por un anillo (un doble cono nodal). Siguiendo la misma tendencia, presentan n-3 nodos radiales.
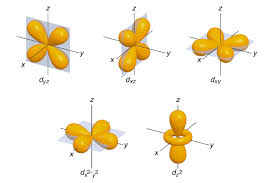
La relación que hay entre los orbitales y los números cuánticos es que n, (número cuántico principal) define el tamaño del orbital. Cuanto mayor sea el número, mayor será el volumen. También tiene influencia en la energía del orbital. "l" (número cuántico del momento angular) indica la forma del del orbital y el momento angular. "ml" (número cuántico magnético) define la orientación espacial del orbital frente a un campo magnético externo.
La notación (procedente de la espectroscopia) es la siguiente:
Orbital s
El orbital s tiene una simetría esférica alrededor del núcleo atómico. Existen dos formas para representar la nube electrónica de un orbital s.
1. La probabilidad de encontrar un electrón disminuye con la medida que nos alejamos del centro.
2. El volumen esférico en el que el electrón pasa la mayor parte del tiempo.
Orbital p
La forma de los orbitales p es la de dos esferasachatadas hacia el punto de contacto y orientadas según los ejes de coordenadas. En la función de valores que pueden tomar el 3 numero cúantico ml (-1, 0 y 1) obtiene los tres orbitales simétricos con respecto a los ejes x, z e y. El orbital p también representa la energía que posee un electrón y se incrementa con la medida en que se aleja entre la distancia del núcleo y el orbital.
Orbital d .
Los orbitales d tienen una forma más diferente: 4 de ellos tienen forma de 4 lóbulos de signos alternados (dos planos nodales, en diferentes orientaciones del espacio), y el último es un doble lóbulo rodeado por un anillo (un doble cono nodal). Siguiendo la misma tendencia, presentan n-3 nodos radiales.
La relación que hay entre los orbitales y los números cuánticos es que n, (número cuántico principal) define el tamaño del orbital. Cuanto mayor sea el número, mayor será el volumen. También tiene influencia en la energía del orbital. "l" (número cuántico del momento angular) indica la forma del del orbital y el momento angular. "ml" (número cuántico magnético) define la orientación espacial del orbital frente a un campo magnético externo.
La notación (procedente de la espectroscopia) es la siguiente:
- Para l = 0, orbitales s
- Para l = 1, orbitales p
- Para l = 2, obitales d
- Para l = 3, orbitales f
- Para l = 4, orbitales g; siguiéndose ya el orden alfabético.
jueves, 7 de abril de 2011
viernes, 11 de marzo de 2011
Radiación elecromagnética 7.3
Tipos de radiación electromagnética:

Banda | Longitud de onda (m) | Frecuencia (Hz) |
Rayos gamma Rayos X Ultravioleta extremo Ultravioleta cercano Luz visible Infrarrojo cercano Infrarrojo medio Infrarrojo lejano Microondas UltraAlta frecuencia MuyAlta frecuencia Onda Corta – radio Onda Media – radio Onda Larga – radio Muy baja frecuencia - radio | < 10 pm < 10 nm < 200 nm <380 nm < 780 nm < 2.5 μm < 50 μm < 1mm < 30 cm < 1 m < 10 m < 180 m < 650 m < 10 km > 10 km | > 30 EHz > 30,0 PHz > 1,5 PHz > 789 THz > 384 THz > 120 THz > 6,00 THz > 300 GHz > 1 GHz > 300 MHz > 30 MHz > 1,7 MHz > 650 KHz > 30 KHz < 30 KHz |

Onda 7.1
7.1
¿Qué es una onda?
R = Es una propagación de una perturbación de alguna propiedad de un medio, por ejmeplo densidad; presión; campo eléctrico o campo magnético, que se propaga a través del espacio transportando energía.
Longitud de onda: Es la distancioa que existe entre 2 crestas consecutivas de dicho tamaño. Es representado por la letra griega: λ (lambda)

Frecuencia: Es el No. de veces que es repetida una vibración , es decir; es una simple repetición de valores por un tiempo determinado. Es representado por la letra: v
Amplitud: Es la distanci vertical entre una cresta y el punto medio de la onda.
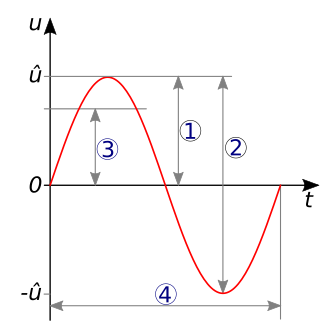
1 = Amplitud,
2 = Amplitud de pico a pico,
3 = Media cuadrática,
4 = Periodo.
¿Qué es una onda?
R = Es una propagación de una perturbación de alguna propiedad de un medio, por ejmeplo densidad; presión; campo eléctrico o campo magnético, que se propaga a través del espacio transportando energía.
Longitud de onda: Es la distancioa que existe entre 2 crestas consecutivas de dicho tamaño. Es representado por la letra griega: λ (lambda)

Frecuencia: Es el No. de veces que es repetida una vibración , es decir; es una simple repetición de valores por un tiempo determinado. Es representado por la letra: v

Amplitud: Es la distanci vertical entre una cresta y el punto medio de la onda.

1 = Amplitud,
2 = Amplitud de pico a pico,
3 = Media cuadrática,
4 = Periodo.
miércoles, 2 de febrero de 2011
Sustancias Anfóteras
¿Qué es una sustancia Anfótera?
En Química, una sustancia anfótera es aquella que puede reaccionar ya sea como un ácido o como una base. La palabra deriva del prefijo griego ampho- (αμφu-) que significa "ambos". Muchos metales (tales como zinc, estaño, plomo, aluminio, y berilio) y la mayoría de los metaloides tienen óxidos o hidróxidos anfóteros.
Otra clase de sustancias anfóteras son las moléculas anfipróticas que pueden donar o aceptar un protón. Algunos ejemplos son los aminoácidos y las proteínas, que tienen grupos amino y ácido carboxílico, y también los compuestos autoionizables como el agua y el amoníaco.
En Química, una sustancia anfótera es aquella que puede reaccionar ya sea como un ácido o como una base. La palabra deriva del prefijo griego ampho- (αμφu-) que significa "ambos". Muchos metales (tales como zinc, estaño, plomo, aluminio, y berilio) y la mayoría de los metaloides tienen óxidos o hidróxidos anfóteros.
Otra clase de sustancias anfóteras son las moléculas anfipróticas que pueden donar o aceptar un protón. Algunos ejemplos son los aminoácidos y las proteínas, que tienen grupos amino y ácido carboxílico, y también los compuestos autoionizables como el agua y el amoníaco.
viernes, 28 de enero de 2011
Tarea pag. 89 y 90
p.89 nr 3.83
2NO(g) + O2(g) ---> 2NO2(g)
0.886moles NO x 2 moles de NO2 / 2 moles de NO = 0.886 moles NO2
0.503 moles O2 x 2 moles NO2 / 1 mol O2 = 1.006 moles de NO2
R= NO es el reactivo limitante
El rendimiento teórico es 0.886 moles NO
p.89 nr 3.85
a) Balance
C3H8 + O2 --> CO2 + H2O
( ver hoja (: )
C3H8 + 5O2 --> 3CO2 + 4H2O
b) Gramos
3.65 moles C3H8 x 3 moles CO2 / 1 mol C3H8 x 44 gr de CO2 / 1 mol CO2 = 481.8 gr CO2
R= A partir de 3.65 moles de C3H8 se produce 481.8 gr CO2
pag. 90 nr 3.89
CaF2 + H2SO4 --> CaSO4 + 2HF
6000 gr de CaF2 x 2 moles HF / 1 mol CaF2 x 20 gr HF / 1 mol HF x 1 mol CaF2 / 78 gr CaF2 = 3077.92 gr HF = 3.07692 kg HF
Rendimiento porcentual: 2.86 kg/ 3.076kg x 100 = 92.95% ~ 93%
pag. 90 nr 3.91
FeTiO3 + H2SO4 --> TiO2 + FeSO4 + H2O
8 x 10^6 gr FeTiO3 x 1 mol TiO2 / 1 mol FeTio3 x 79.88 gr TiO2 / 1 mol TiO2 x 1 mol FeTiO3 / 151.73 gr FeTiO3 = 4211691.82 gr = 4211.69 kg TiO2
Rend. % = 3.67x 10^3 / 4211.69 x 100 ~ 87.13%
2NO(g) + O2(g) ---> 2NO2(g)
0.886moles NO x 2 moles de NO2 / 2 moles de NO = 0.886 moles NO2
0.503 moles O2 x 2 moles NO2 / 1 mol O2 = 1.006 moles de NO2
R= NO es el reactivo limitante
El rendimiento teórico es 0.886 moles NO
p.89 nr 3.85
a) Balance
C3H8 + O2 --> CO2 + H2O
( ver hoja (: )
C3H8 + 5O2 --> 3CO2 + 4H2O
b) Gramos
3.65 moles C3H8 x 3 moles CO2 / 1 mol C3H8 x 44 gr de CO2 / 1 mol CO2 = 481.8 gr CO2
R= A partir de 3.65 moles de C3H8 se produce 481.8 gr CO2
pag. 90 nr 3.89
CaF2 + H2SO4 --> CaSO4 + 2HF
6000 gr de CaF2 x 2 moles HF / 1 mol CaF2 x 20 gr HF / 1 mol HF x 1 mol CaF2 / 78 gr CaF2 = 3077.92 gr HF = 3.07692 kg HF
Rendimiento porcentual: 2.86 kg/ 3.076kg x 100 = 92.95% ~ 93%
pag. 90 nr 3.91
FeTiO3 + H2SO4 --> TiO2 + FeSO4 + H2O
8 x 10^6 gr FeTiO3 x 1 mol TiO2 / 1 mol FeTio3 x 79.88 gr TiO2 / 1 mol TiO2 x 1 mol FeTiO3 / 151.73 gr FeTiO3 = 4211691.82 gr = 4211.69 kg TiO2
Rend. % = 3.67x 10^3 / 4211.69 x 100 ~ 87.13%
jueves, 13 de enero de 2011
Tarea pag. 88 y 89 nr. 3.75,3.69,3.65,3.77
3.65.
Apartir de 3,60 mol de CO se produce 3,60 moles CO2
3.69.
Apartir de 26 millones de toneladas SO2 se produce 1.301217608x10^13 gr S
3.75.
Apartir de 1kg de CaCO3 se produce 560.8 gr CaO
3.77.
Apartir de 1.00x10^5 kg de (NH4)2SO4 se produce 25,757.57576 kg de NH3
Suscribirse a:
Entradas (Atom)

















